СО2-ЭКСТРАКТЫ СЕМЯН ПЕТРУШКИ И УКРОПА КОМПАНИИ КАРАВАН
В СИНТЕЗЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ
Семенов Виктор Владимирович
Выделение ценных компонентов из растительного сырья для нужд тонкой органической химии и фармацевтики особенно актуально в том случае, когда этот процесс экономически и экологически более эффективен, чем синтетическое производство. Для создания таких технологий, во-первых, требуется найти растения с достаточно высоким содержанием необходимых метаболитов. Во-вторых, необходимо использовать сырье, производящееся в больших масштабах – в этом плане сельскохозяйственные культуры с уже отлаженной технологией выращивания и сбора урожая более удобны, чем дикорастущие. В-третьих, следует базироваться на существующих промышленных технологиях переработки растительного сырья.
Анализ современной литературы1 и баз данных2 по составу и биологическим свойствам более 30 000 видов растений показал, что в культурах семейства зонтичных (петрушка, сельдерей, укроп, тмин и др.) содержатся разнообразные полиалкоксиаллилбензолы — апиол, диллапиол, миристицин, элемицин и аллилтетраметоксибензол (Рис. 1). В рамках национального проекта США по изучению растительного сырья2 для каждого из этих компонентов было выявлено от 10 до 30 типов фармакологической активности: действие на сердечно-сосудистую, моче-половую, центральную нервную систему, противоинфекционная активность. Хорошо известен наркотический эффект миристицина. Запатентованы антимикробная и антифунгицидная активность полиалкоксибензолов3. Диллапиол имеет перспективы применения в комбинации со многими антираковыми препаратами, поскольку сильно снижает резистентность клеток к антимитотическим лекарственным средствам4. Интересно, что в Великобритании в средние века петрушку, содержащую большое количество апиола, использовали как мощное абортивное средство.
Благодаря наличию реакционноспособной аллильной группы и активированного ароматического кольца полиалкоксибензолы являются многосторонними перспективными строительным блоками для тонкого органического синтеза. Получать в промышленном масштабе такие молекулы трудно, долго и дорого, но семена петрушки и укропа сами по себе являюся прекрасным “заводом” по изготовлению сложных молекул, где их можно найти в в значительных количествах. Анализ 28 сортов семян петрушки из различных европейских стран показал, что содержание полиметоксибензолов сильно меняется (от 10 до 70%) в зависимости от района произрастания и фенотипа. Существуют три фенотипа петрушки – апиоловый (содержание апиола в эфирном масле 58–80%), миристициновый (49–77% миристицина) и аллилтетраметоксибензольный (52–57% аллилтетраметоксибензола) с примесью миристицина (26–37%)5, причем распределение этих веществ между семенами, листьями и корнями петрушки сильно варьирует5-7. Необходимо отметить и различную эфиромасличность этих частей, причем максимальное содержание масла характерно для семян (3,5–6,7%)8.
Изучены экстракты листьев 104 сортов петрушки многих стран6. Оказалось, что экстракт сорта из Югославии содержит много миристицина (50–60%)6, гораздо больше, чем в мускатном орехе – главном источнике этого соединения. В петрушке из Ирана и Турции основным продуктом метаболизма является 1,3,8-п-ментатриен6 (1,3,8-p-menthatriene). В экстракте семян индийского укропа обнаружено 30-50% диллапиола9,10, в то время как культуры северных широт (например, тмин из Красноярского края11 или укроп из Финляндии12) вообще не содержат диллапиола. Однако ни в одной из вышеуказанных работ не приводятся названия исследованных сортов петрушки.
Cостав отечественных промышленных экстрактов семян петрушки и укропа до недавнего времени не был исследован. По этим причинам невозможно было выбрать конкретные сорта с высоким содержанием полиалкоксибензолов для их препаративного извлечения. С целью поиска промышленного сырья – потенциального источника полиалкоксибензолов – Институтом органической химии совместно с компанией Караван были получены СО2-экстракты семян 15 сортов петрушки и укропа из различных регионов. Состав экстрактов был проанализирован методами хромато-масс-спектрометрии и газовой хроматографии. Среди многих сортов семейства зонтичных основным источником апиола (содержание более 70%) оказалась отечественная петрушка «Корневая» сорт «Сахарная». Отечественная петрушка «Кудрявая» сорт «Астра» хорошо подходит для получения миристицина (46%), содержание которого оказалось выше, чем в промышленном источнике — эфирном масле мускатного ореха (около 20%). Эфирные масла семян большинства сортов отчественной петрушки содержат до 15% аллилтетраметоксибензола, а масла индийских и узбекских сортов укропа – 30–35% диллапиола.
На заводе Краснодарской компании «Караван отработана технология СO2-экстракции, позволяющая получать экстракты с высоким содержанием полиалкоксиаллилбензолов. Важнейшей стадией процесса выделения полиакоксиаллилбензолов из экстрактов является процесс многостадийной ректификации. В результате отработки процесса ректификации на пилотных установках Института Органической химии им. Н. Д. Зелинского было переработано около 100 литров СО2-экстрактов, полученных из 2,5 тонн семян петрушки и укропа различных сортов. Выделено около 40 кг апиола (чистота 98–99%), 3 кг диллапиола (98–99%), 5,5 кг миристицина (98%), 0,3 кг аллилтетраметоксибензола (97%). Миристицин отделяется высокоэффективной ректификацией от элемицина несмотря на близкие значения их температур кипения (Tкип = 1 C).
 Рис. 1. Ректификация аллилполиметоксибензолов на пилотной уcтановке ИОХ.
Рис. 1. Ректификация аллилполиметоксибензолов на пилотной уcтановке ИОХ.
Перспективным направлением использования компонетов СО2-экстрактов семян петрушки и укропа является синтез аналогов природных ингибиторов деления клеток (цитостатиков), то есть веществ, широко применямых в химиотерапии онкологических заболеваний. «Перечень жизненно необходимых и важнейших лекарственных средств», утвержденный в 2003 г. в Российской Федерации, включает 47 препаратов-цитостатиков для химиотерапии рака. В США в список утвержденных противоопухолевых лекарственных средств входят 50 препаратов, 5 из которых представляют так называемые митотические яды винка-алкалоиды и таксоиды. Механизм их действия связан с нарушением динамики и структуры микротрубочек. В ряде обзоров опубликованно достаточно много природных соединений с полиалкоксифенильными фрагментами (Рис.2), которые обладают мощным антимитотическим действием, в том числе за счет ингибирования полимеризации тубулина и нарушения структуры и функции митотического веретена. Большинство из них действует на колхициновый сайт тубулина.
Многие природные полиметоксибензолы (колхицин, стеганацин, подофиллотоксин, комбретастатины, носкапин, Рис. 2) и их производные рассматриваются в качестве противоопухолевых лекарственных средств в клинической. медицине.13 Все они содержатся в ограниченно распространенных растениях, в основном тропических. Исключение составляет только колхицин, который выделен из безвременника осеннего, культивируемого в наших садах как декоративное растение. Во всех этих веществах присутствует полиметоксибензольный фрагмент, характерный также для метаболитов петрушки и укропа, что позволило использовать отечественные
СО2-экстракты в качестве доступного сырья для синтеза аналогов природных цитостатиков.
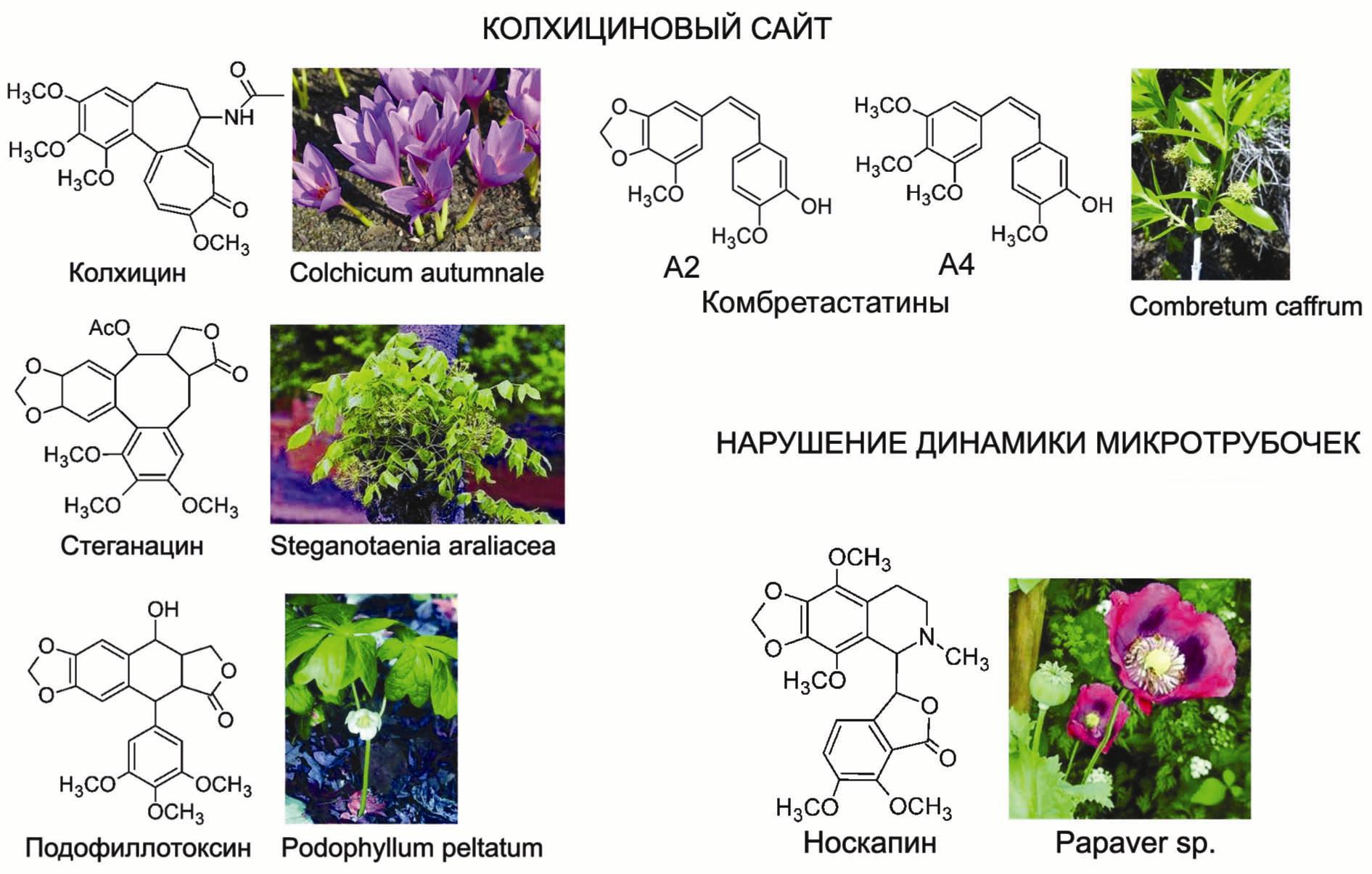
Рис.2. Природные практически важные ингибиторы полимеризации тубулина, содержащие полиалкоксифенильный фрагмент.
Технология переработки аллилполиметоксибензолов в ключевые «строительные блоки» (полиалкокси-ароматические альдегиды, кислоты, нитрилы, фенолы, спирты и др.), необходимые для синтеза отечественных аналогов природных противоопухолевых веществ, разработана с применением дешевых отечественных реагентах. На первой стадии получения альдегидов использовался специально сконструированный в Санкт-Петербургском Государственном техническом университете озонатор, оснащенный инфракрасным датчиком концентрации озона с электронной системой, что позволяло вводить в реакцию строго эквимольные количества озона. В таких условиях конверсия исходных аллилбензолов составляла около 90%, и практически не протекали побочные реакции. В результате было получено более десятка молекул (наиболее активные структуры представлены на Рис. 3), нарушающих деление опухолевых клеток в более низких концентрациях
(0.25–5 nM ), чем природные импортные митостатики (Рис. 2).
Рис. 3. Наиболее активные антимитотики – ингибиторы роста опухолевых клеток человека, синтезированные с использованием промышленных экстрактов семян петрушки и укропа.
Биологические исследования показали, что мишенью этих веществ служит белок тубулин – основной компонент митотического веретена, обеспечивающего в процессе клеточного деления правильную ориентацию хромосом и их расхождение по дочерним клеткам. В интенсивно делящихся опухолевах клетках нарушение структуры и функции митотического веретена приводит к неспособности клеток завершить деление или к аномальному делению и в конечном итоге к гибели. Дальнейшее тестирование in vitro на культурах 60 линий опухолевых клеток человека и in vivo на мышах проводилось в Национальном институте рака США (г. Бетесда), с которым у Института Органической химии им. Н. Д. Зелинского РАН налажено сотрудничество. Основные результаты по синтезу и биологической активности полученных веществ с антимитотическим действием, перспективных для разработки новых противоопухолевых средств, опубликованы в ведущих европейских и американских журналах14-24.
Литература
1. Б.Н.Головкин, Р.Н.Руденская, И.А.Трофимова, А.И.Шретер. Биологически
активные вещества растительного происхождения. Москва Наука 2001-2002,
I–III т.
2. База данных по растениям США http://www.ars-grin.gov/duke/
3. B.A. Burke, M.G. Nair, US Pat. 4876277 (1987), приоритет 29.05.1987,
опубликовано 24.10.1989; С.А. 1990, v. 112: 216908f.
4. P.Juranka, C. Morris, T.Durst, J.Arnason, C.Bernard “Use of Dillapiol and Its
Analogs and Derivatives to affect Multidrug Resistant Cells. Canada Pat. 2198645,
приоритет 27.02.1997, опубликовано 27.08.1998 С.А. 1999, v. 131: 27947z.
5. E.Stahl, H.Jork, Archiv der Pharmazie, 1964, 297, 273.
6. J.E.Simon, J.Quinn J. Agric. Food Chem. 1988, 38, p. 467.
7. Б.Виноградов, Н.Виноградова, Л.Голан “Ароматерапия”, учебный курс, Fultus
Publishing, P.O. Box 50095 Palo Alto CA 94303, USA, 2006.
8. http://www.eda-server.ru/prjan/045.shtml
9. E.P.Lichtenstein, T.T.Liang, K.R. Schulz, H.R.Schnoes, G.T.Carter. J. Agric.
Food. Chem. 1974, 22, 658.
10. S.S.Tomar, M.L.Maheshwari, S.K.Mukerjee, J. Agric. Food. Chem. 1979, 27, 548.
11. И.В.Кротова, А.А.Ефремов. Химия растительного сырья, 2002, №3, с.29.
12. R. Huopalahti and R.R. Linko, J. Agric. Food Chem., 1983, 31, (2) 331.
13. Koehn, Frank E. Natural products and cancer drug discovery. Humana Press,
2013.
14. Semenov V V, Rusak V V, Chartov E M, Zaretskii M I I, Konyushkin L D, Firgang S I, Chizhov A O, Elkin V V, Latin N N, Bonashek V M, Stas’eva O N. Polyalkoxybenzenes from plant raw materials 1. Isolation of polyalkoxybenzenes from CO2 extracts of Umbelliferae plant seeds. Russ. Chem. Bull., 2007, v. 56, № 12, pp. 2448–2455.
15. Semenov V.V., Kiselyov A.S., Titov I.Y., Sagamanova I.K., Ikizalp N., Chernysheva N.B., Tsyganov D.V., Konyushkin L.D., Firgang S.I., Semenov R.V., Karmanova I.B., Semenova M.N. Synthesis of antimitotic polyalkoxyphenyl derivatives of combretastatin using plant allylpolyalkoxybenzenes. J. Nat. Prod., 2010, v. 73, pp. 1796–1802.
16. Titov I.Y., Sagamanova I.K., Gritsenko R.T., Karmanova I.B., Atamanenko O.P., Semenova M.N., Semenov V.V. Application of plant allylpolyalkoxybenzenes in synthesis of antimitotic phenstatin analogues. Bioorg. Med. Chem. Lett. 2011, v. 21, pp. 1578–1581.
17. Semenova M.N., Kiselyov A.S., Tsyganov D.V., Konyushkin L.D., Firgang S.I., Semenov R.V., Malyshev O.R., Raihstat M.M., Fuchs F., Stielow A., Lantow M., Zefirov N.S., Philchenkov A., Zavelevich M., Kuznetsov S.A., Semenov V.V. Polyalkoxybenzenes from plants. 4. Dill and parsley seed extracts in synthesis of azapodophyllotoxins featuring strong tubulin destabilizing activity in the sea urchin embryo and cell culture assays. J. Med. Chem., 2011, v. 54, № 20, pp. 7138–7149.
18. Chernysheva N.B., Tsyganov D.V., Philchenkov A.A., Zavelevich M.P., Kiselyov A.S., Semenova M.N., Semenov V.V. Synthesis and comparative evaluation of 4-oxa- and 4-aza-podophyllotoxins as antiproliferative microtubule destabilizing agents. Bioorg. Med. Chem. Lett., 2012, v. 22, pp. 2590–2593.
19. Shestopalov A.M., Litvinov Y.M., Rodinovskaya L.A., Semenova M.N., Semenov V.V. Polyalkoxy substituted 4H-chromenes: Synthesis by domino reaction and anticancer activity. ACS Comb. Sci., 2012, v. 14, pp. 484–490.
20. Tsyganov D.V., Chernysheva N.B., Salamandra L. K., Konyushkin L.D., Semenova M.N., Semenov V.V. Synthesis of polyalkoxy-3-(4-phenyl)coumarins with antimitotic activity using plant allylbenzenes. Mendeleev Commun., 2013, v. 23, issue 3, pp. 147–149.
21. Tsyganov D.V., Konyushkin L.D., Karmanova I.B., Strelenko Y. A., Semenova M.N., Kiselyov A.S., Semenov V.V. cis-Restricted 3-aminopyrazole analogues of combretastatins: Synthesis from plant polyalkoxybenzenes and biological evaluation in the cytotoxicity and phenotypic sea urchin embryo assays. – J. Nat. Prod. 2013, v. 76, pp. 1485–1491.
22. Demchuk D.V., Samet A.V., Chernysheva N.B., Ushkarov V.I., Stashina G.A., Konyushkin L.D., Raihstat M.M., Firgang S.I., Philchenkov A.A., Zavelevich M.P., Kuiava L.M., Chekhun V.F., Blokhin D.Yu., Kiselyov A.S., Semenova M.N., Semenov V.V. Synthesis and antiproliferative activity of conformationally restricted 1,2,3-triazole analogues of combretastatins in the sea urchin embryo model and against human cancer cell lines. – Bioorg. Med. Chem., 2014, v. 22, pp. 738–755.
23. Tsyganov D.V., Khrustalev V.N., Konyushkin L.D., Raihstat M.M., Firgang S.I., Semenov R.V., Kiselyov A.S., Semenova M.N., Semenov V.V. Regioisomers of 3-(5-)-amino-o-diarylisoxazoles: Synthesis from plant allyl polyalkoxybenzenes and antitubulin activity. – Eur. J. Med. Chem., 2014, v. 73, pp. 112–125.
24. Semenova M. N., Tsyganov D.V., Malyshev O.R., Ershov O.V., Bardasov I.N., Semenov R.V., Kiselyov A.S., Semenov V.V. Comparative in vivo evaluation of polyalkoxy substituted 4H-chromenes and oxa-podophyllotoxins as microtubule destabilizing agents in the phenotypic sea urchin embryo assay. Bioorg. Med. Chem Lett., 2014, v. 24, pp. 3914–3918.
СО2-EXTRACTS OF PARSLEY AND DILL SEEDS, PRODUCED BY KARAWAN COMPANY, IN SYNTHESIS OF ANTICANCER SUBSTANCES
Semenov Victor Vladimirovich
Extraction of valuable components from plant raw materials for the needs of fine organic chemistry and pharmacy is of particular interest in those cases when such process is more efficient economically and ecologically than their synthetic production. For development of such technologies first of all it is required to find out plants with fairly high content of appropriate metabolites. Second, it is necessary to use raw materials, produced at a large scale – in this respect agricultural crops, cultivated according to well-known growing and harvesting technologies, are more suitable than wild plants. Third, it will be more efficient to make use of existing industrial technologies of plant raw materials processing.
Analysis of current literature 1 and data bases 2 with description of composition and biological properties of over 30 000 species of plants has shown that parsley family plants (parsley, celery, dill, caraway, etc.) contain various polyalkoxyallylbenzenes – apiole, dillapiole, myristicin, elemicin and allyltetramethoxybenzene (fig. 1). Within the scope of USA National Project for study of plant raw materials 2 there were determined from 10 to 30 types of pharmacological activity for each of the above components: action on cardiovascular, urogenital, central nervous systems, anti-infective effect. Narcotic action of myristicin is well-known. There were patented antimicrobial and antifungicidal effects of polyalkoxybenzenes 3. Dillapiole seems to be perspective for application in combination with many anticancer drugs as it strongly decreases cell resistance to antimitotic medicinal products 4. It is noteworthy that in Great Britain in the Middle Ages parsley, which is rich in apiole content, was used as a strong abortive remedy.
Due to availability of reactive allyl group and activated aromatic ring polyalkoxybenzenes represent perspective versatile building blocks for fine organic synthesis. Commercial production of such molecules is rather laborious, durable and expensive, however parsley and dill seeds may be used as perfect natural “factory” for production of complicated molecules because such seeds contain a great number of them. Study of 28 parsley seeds varieties from various European countries showed that content of polymethoxybenzenes differs greatly (from 10 to 70 %) depending on growing region and phenotype. There are three parsley phenotypes – apiole (58 – 80% apiole content in essential oil), myristicin (49–77% of myristicin) and allyltetramethoxybenzene (52–57% of allyltetramethoxybenzene) admixed with myristicin (26–37%) 5, and distribution of such substances between parsley seeds, leaves and roots is varied greatly 5-7. It should be noted that such parts also have various essential oil content, maximum oil content being characteristic for seeds (3,5–6,7%) 8.
Leaf extracts of 104 parsley varieties from many countries were studied 6. It was found that the Yugoslavian variety extract contained considerable quantity of myristicin (50–60%)6, much more than in nutmeg – the main source of such compound. In parsley from Iran and Turkey the basic metabolic product is 1,3,8-p-menthatriene 6. In extract from Indian dill seeds it was determined 30-50% of dillapiole 9,10, whereas crops of the northern latitudes (for instance, caraway from the Krasnoyarsk Region 11 or dill from Finland 12) contain no dillapiole at all. However none of the abovementioned papers has reference to researches of any parsley species.
Composition of home-produced commercial extracts from parsley and dill seeds was not studied until recently. Therefore it was impossible to choose any specific varieties with high content of polyalkoxybenzenes for their preparative extraction. Aiming at searching for industrial raw materials – potential sources of polyalkoxybenzenes – the Institute of Organic Chemistry in cooperation with the Karawan Company obtained CO2– extracts of 15 varieties of parsley and dill seeds from various regions. Composition of such extracts was analyzed with the methods of combined gas chromatography mass-spectrometry. And it was determined that among a lot of parsley family varieties the main source of apiole (with apiole content over 70%) was the home-grown “Root parsley” of “Sugar” variety. The home-grown “Curled leaf parsley” of “Aster” variety is well suitable for production of myristicin (46%), its content is higher than in the industrial source – nutmeg essential oil (about 20%). Essential oils in majority of home-grown parsley varieties contain up to 15 % of allyltetramethoxybenzene, and oils of Indian and Uzbek dill varieties – 30–35% of dillapiole.
At the plant of Krasnodar Karawan Company there was developed and implemented the СO2-extraction technology resulting in production of extracts with high content of polyalkoxyallylbenzenes. The most important procedure in separation of polyalkoxyallylbenzenes from such extracts is the multistage rectification process. During test trial of rectification process at the pilot plants of the Institute of Organic Chemistry n.a. N.D.Zelinsky (IOC) there was carried out processing of about 100 liters of СO2-extracts, produced from 2.5 tons of different varieties of parsley and dill seeds. There were isolated about 40 kg of apiole (98–99% purity), 3 kg of dillapiole (98–99%), 5.5 kg of myristicin(98%), 0.3 kg of allyltetramethoxybenzene (97%). Myristicin is separated from elemicin by means of high efficient rectification in spite of close values of their boiling points (Tbp = 1 C).
A promising direction for use of СO2-extract components of parsley and dill seeds will be synthesis of analogs of natural cell division inhibitors (cytostatic drugs), that is substances, which may be widely used for chemical therapy of oncological diseases. “The List of life-saving and essential medicinal products”, approved in 2003 in the Russian Federation, includes 47 cytostatic drugs for cancer chemotherapy. In USA the list of approved anticancer medicinal products includes 50 drugs, 5 of them being referred to so-called mitotic poisons, vinca alkaloids and taxoids. Mechanism of their action is connected with damage of microtubule dynamics and structure. A number of reviews published information about rather many natural compounds with polyalkoxyphenyl fragments (fig. 2), which have strong antimitotic effect without limitation due to inhibition of tubulin polymerization and damage of mitotic spindle structure and function. Major part of them affects the colchicinic site of tubulin.

Fig. 1. Rectification of allylpolymethoxybenzenes at the IOC pilot plant.
1 – allyltetramethoxybenzene 0.3 kg; 2 – apiole 40 kg; 3 – dillapiole 3.5 kg;
4 – elemicin; 5 – myristicin 5.5 kg; Tbp ~ 1 ; 6 – Degree of purification 97-99 %
Many natural polymethoxybenzenes (colchicine, steganacin, podophyllotoxine, combretastatin, noscapine, fig. 2) and their derivatives are regarded as anticancer drugs in clinical medicine 13. Most of them are present in stenocoenose plants, mainly in tropical ones. The only exception is colchicine, which is isolated from autumn crocus, cultivated in our gardens as a decorative plant. All these substances contain polymethoxybenzene fragment, which is also characteristic for parsley and dill metabolites, thus making it possible to use domestic СO2-extracts as available raw material for synthesis of natural cytostatic agents.

Fig.2. Practically important natural inhibitors of tubulin polymerization, containing polyalkoxyphenyl fragment.
1 – colchicinic site; 2 – colchicine; 3 – steganacin; 4 – podophyllotoxine;
5 – combretastatins; 6 – damage of microtubule dynamics; 7 – noscapine
Technology of allylpolymethoxybenzenes processing into the key “building blocks” (polyalkoxy-aromatic aldehydes, acids, nitriles, phenols, alcohols, etc.), required for synthesis of domestic analogs of anticancer substances, was developed with usage of cheap home-produced reagents. At the initial stage of aldehydes production there was used a special ozonator, designed for such purpose at the Saint-Petersburg State Technical University, equipped with infrared ozone sensor with electronic system, which put into reaction strictly equimolar doze of ozone. Under such conditions conversion of source allylbenzenes was about 90 %, and actually no side reaction took place. It resulted in preparation of more than ten molecules (the most active structures are shown in fig. 3), which destroy cancer-cell division in lower concentrations (0.25–5 nM ), than natural foreign mitostatics (fig. 2).

Fig. 3. Most active mitotics – inhibitors of human cancer-cell growth, synthesized with usage of industrial extracts of parsley and dill seeds.
1 – Analogs of podophyllotoxine; 2 – Analogs of combretastatin; 3 – Analogs of glaziovianin, Glaziovianin A
Biological researches showed that the target of such substances was protein of tubulin – basic component of mitotic spindle, in the process of cell division controlling proper orientation of chromosomes and their distribution to daughter cells. In intensively fissionable cancer cells damage of mitotic spindle structure and function results in the cells failure to finish their division or causes their abnormal division and finally leads to death of such cells. Further testing in vitro on cultures of 60 lines of human cancer cells and in vivo on mice was carried out at the USA National Institute of Cancer (Betesda city), as the Institute of Organic Chemistry n.a. N.D.Zelinsky established cooperation relations with this institution. Principal results on synthesis and biological activity of isolated substances with antimitotic action, which are promising for development of new anticancer drugs, are published in the leading European and American journals 14-24.
Bibliography:
1. B.N.Golovkin, R.N.Rudenskaya, I.A.Trofimova, А.I.Shreter. Biologically
active substances of plant origin. Moscow, Science 2001-2002, I-III v.
2. Data base of USA plants: http://www.ars-grin.gov/duke/
3. B.A. Burke, M.G. Nair, US Pat. 4876277 (1987), priority as of 29.05.1987,
published on 24.10.1989; С.А. 1990, v. 112: 216908f.
4. P.Juranka, C. Morris, T.Durst, J.Arnason, C.Bernard “Use of Dillapiol and Its
Analogs and Derivatives to affect Multidrug Resistant Cells. Canada Pat. 2198645,
priority as of 27.02.1997, published on 27.08.1998 С.А. 1999, v. 131: 27947z.
5. E.Stahl, H.Jork, Archiv der Pharmazie, 1964, 297, 273.
6. J.E.Simon, J.Quinn J. Agric. Food Chem. 1988, 38, p. 467.
7. B.Vinogradov, N.Vinogradova, L.Golan “Aromatherapy”, training courseс, Fultus
Publishing, P.O. Box 50095 Palo Alto CA 94303, USA, 2006.
8. http://www.eda-server.ru/prjan/045.shtml
9. E.P.Lichtenstein, T.T.Liang, K.R. Schulz, H.R.Schnoes, G.T.Carter. J. Agric.
Food. Chem. 1974, 22, 658.
10. S.S.Tomar, M.L.Maheshwari, S.K.Mukerjee, J. Agric. Food. Chem. 1979, 27, 548.
11. I.V.Krotova, А.А.Efremov. Chemistry of plant raw materials, 2002, №3, p.29.
